Protein Degradation
Expanding the drug design paradigm
Cullgen utilizes our ubiquitin-mediated, small molecule-induced target elimination technology, uSMITE™, to develop novel therapeutics for various difficult to treat diseases, including cancer, inflammation, autoimmune diseases, and neurodegenerative diseases.
Traditionally, small molecule drugs are designed to modulate the functional sites of proteins and block the activity. Through the use of targeted protein degraders, we are able to expand the drug design paradigm beyond functional site inhibition – making it possible to eliminate previously “undruggable” enzymes and proteins by using targeted destruction.
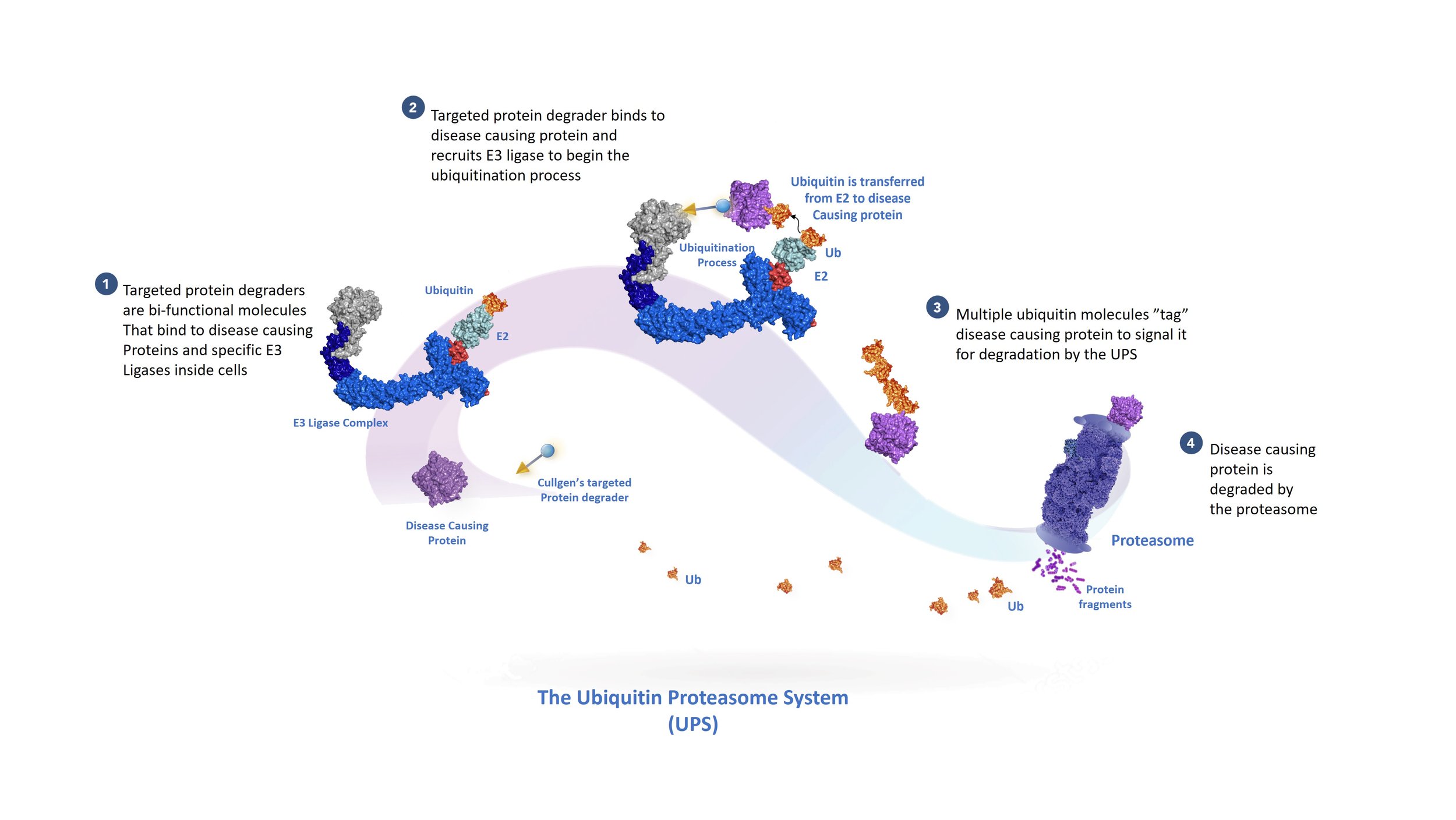
Our targeted protein degrader technology harnesses the body’s innate ubiquitin-proteasome system to destroy disease-cauing proteins. Take a walk through this system with us as we explore why it is so fundamental to the human body.
泛素-蛋白酶体系统
泛素是一种由76个氨基酸组成的蛋白。泛素存在于所有真核物种并在几乎所有人体细胞中普遍表达。通过一系列被称为泛素化的酶促反应,泛素和其他蛋白(底物蛋白)形成共价链接。泛素化分为两种,一种是底物蛋白链接单个泛素(称为单泛素化),另一种是在底物链接泛素链(称为多泛素化)。被多泛素链标记的底物蛋白通常被26S蛋白酶体降解为多肽或者氨基酸。
蛋白降解是生物体调节细胞中蛋白质的量和活性的一种重要机制。泛素-蛋白酶体系统参与调节几乎所有的细胞过程,包括细胞生长、增殖、迁移、分化,和死亡等。如果这个降解系统出现问题会导致许多人类疾病,例如发育迟缓、神经退行性疾病、免疫疾病、心血管病和癌症。2004年的诺贝尔化学奖授予三位以色列科学家,Aaron Ciechanover、Avram Hershko 和 Irwin Ros,以表彰他们早期发现泛素化酶促机制所做贡献。
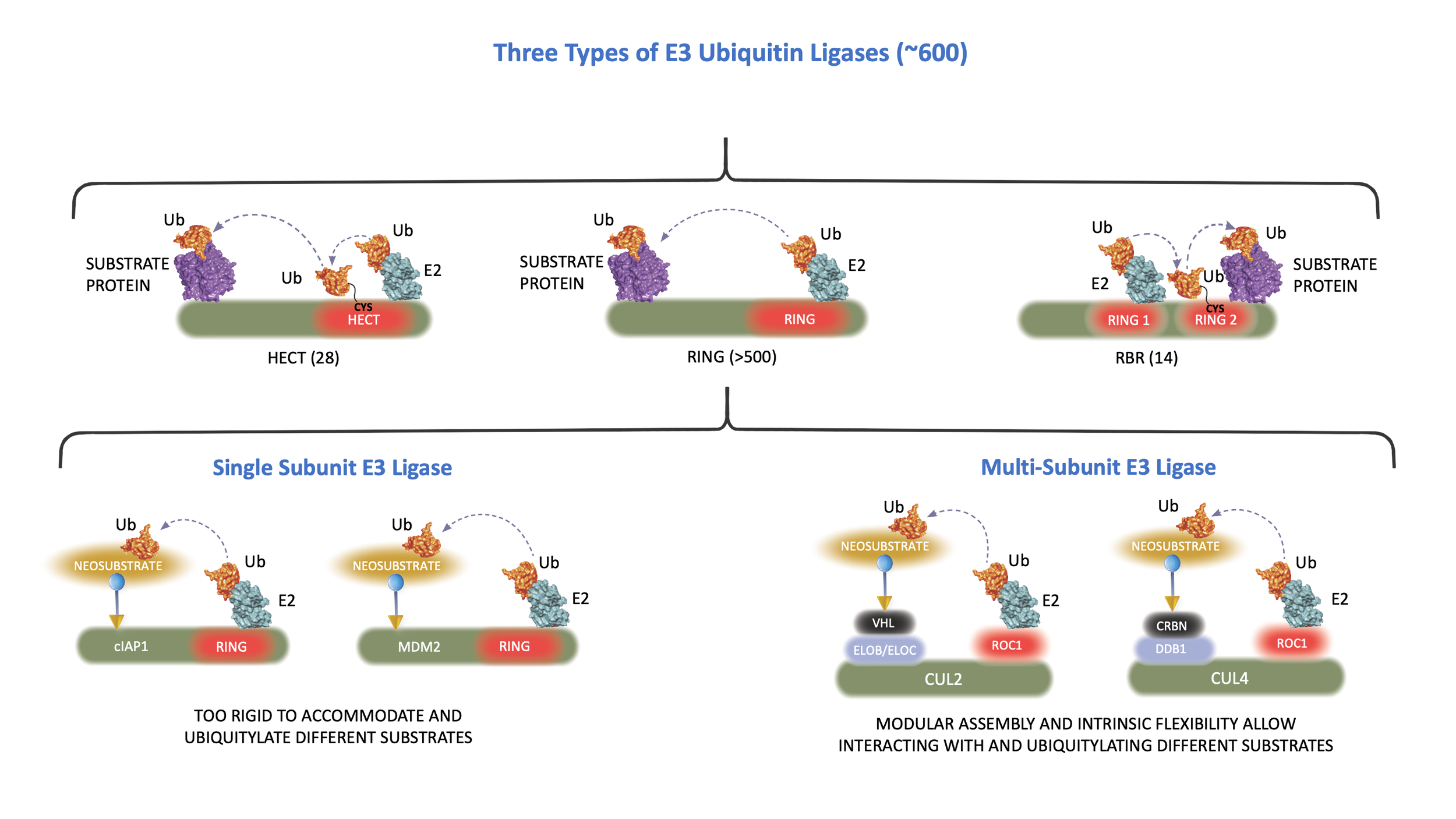
泛素化是一个由三个酶连续催化的生化过程:首先,泛素被泛素激活酶(E1)利用能量分子ATP“激活”。接着,激活的泛素从E1转移到泛素结合酶(E2)。最后,泛素连接酶(E3)将泛素从E2共价链接到底物蛋白。E3链接酶决定何时、何地以及哪些蛋白质被泛素标记。据估计,人类细胞拥有600多种E3连接酶,不同E3链接酶催化特定底物蛋白的泛素化,进而快速,准确的调控不同的细胞功能。基于对泛素降解系统超过20年的基础研究,Cullgen的科学家们正在探索如何利用泛素-蛋白酶体系统来选择性的降解致病蛋白。
E3链接酶可被小分子用来降解疾病蛋白
绝大多数E3泛素链接酶具有环指结构,介导泛素从 E2转移到靶蛋白。环指E3链接酶有两大类:一类是内含环指结构域,另一类是通过支架蛋白cullin家族与环指蛋白ROC1或ROC2结合。单个cullin蛋白可以与多种不同的底物受体蛋白直接或间接地结合,进而组成超过300多个不同的cullin-RING E3 ligases (CRLs)。 CRL具有高度灵活性,并且能专一性的识别数量巨大的不同底物蛋白。这种高度的灵活性和专一性奠定靶向蛋白降解的基础。
认识到E3链接酶可被小分子用来降解疾病蛋白的潜能,Cullgen的科学家正在利用这一前所未有的机制来进行新药开发,尤其是针对过去无法开发的药物靶点。公司专有的“小分子诱导泛素依赖性靶点清除”(ubiquitin-mediated, small molecule-induced target elimination , uSMITE™)技术平台,正是基于蛋白质降解科学的最新前沿技术。我们以这一革命性的平台为核心,致力于针对癌症、炎症和自身免疫疾病的新药开发。与传统的药物开发相比,uSMITE™具有多种优势,包括早期先导化合物的快速开发,验证靶标特异性的简易性和全面性、药物计量的高效性,以及克服药物抗性等。更重要的是,小分子诱导的蛋白质降解不限于基于功能位点的传统药物靶点,可以用于以往无法成药的关键致病靶点,例如转录因子、支架蛋白和其他非酶调节蛋白。此外,E3连接酶的特异性表达使之有可能达到选择性的在特定的组织、疾病细胞或者亚细胞区对疾病蛋白进行特异性降解,进而降低药物毒性和提高药效。